 | |
Fórmula química del citrato de clomifeno | |
CITRATO DE CLOMIFENO
El citrato de clomifeno (CC) es un derivado no esteroideo que tiene propiedades tanto de agonista como de antagonista de los estrógenos. Es degradado por vía hepática y excretado por las heces. Cerca del 85% de la dosis administrada es eliminada en unos 6 días, a pesar de que se pueden encontrar trazas en sangre durante un tiempo mayor.
Mecanismo de acción.Este medicamento actúa mediante la inducción de la liberación de la hormona FSH y LH, las cuales provocan la ovulación. Dicha inducción no es directa, sino que el citrato de clomifeno lo que hace es provocar que el organismo libere dos o tres veces más de la cantidad normal de estrógeno, al bloquear los receptores hipotalámicos del estradiol. Esto provoca el bloqueo de la retroalimentación negativa del estradiol, y en consecuencia se activa la secreción de GnRH aumentando la FSH y LH.
El efecto antiestrogénico sobre el endometrio y el moco cervical hacen que, en algunas pacientes, disminuya el espesor endometrial y la cantidad de moco cervical. Por esta razón, en los esquemas de inducción con citrato de clomifeno se utilizan medicamentos con estrógenos para contrarrestar este efecto.
Dosis. El citrato de clomifeno es absorbido rápidamente por vía oral. Se administra en dosis de entre 50-250mg al día, durante cinco días, a partir del día 2, 3, 4 o incluso 5, después de la regla espontánea o inducida. Se comienza con la dosis más pequeña y se va aumentando en 50mg/día por ciclo, hasta conseguir una ovulación. El citrato de clomifeno es absorbido rápidamente por vía oral. Se administra en dosis de entre 50-250mg al día, durante cinco días, a partir del día 2, 3, 4 o incluso 5, después de la regla espontánea o inducida. Se comienza con la dosis más pequeña y se va aumentando en 50mg/día por ciclo, hasta conseguir una ovulación.
Uso inadecuado. El empleo imprudente en numerosas ocasiones, administrándose sin un adecuado control de los eventos del ciclo, ha dado lugar a gestaciones múltiples, como consecuencia de la inducción del desarrollo de varios folículos al mismo tiempo por la secreción contínua de FSH. El riesgo de gestación múltiple es de entre 8 y 13%. Para evitarlo, es necesaria una contínua monitorización del ciclo: seguimiento ecográfica del crecimiento folicular, medida de los niveles de estradiol,interrumpiéndose el ciclo cundo hay más de un folículo preovulatorio.
Indicaciones y contraindicaciones. El citrato de clomifeno es la droga de elección para la mayoría de las pacientes con anovulación que desean salir embarazadas. Sin embargo, no se debe iniciar este tratamiento sin realizar un estudio completo que permita conocer cuál es la causa de la alteración de la ovulación.
 | |
Lactancia materna | |
Existen parejas en las que se realiza un estudio completo y no se conoce cuál es la causa de la infertilidad y, por eso, la llamada “infertilidad de causa desconocida” es un reto para el clínico y una frustración para la pareja que considera que sin un diagnóstico preciso, no existe un tratamiento adecuado. Sin embargo, hay técnicas que permiten la solución del donde uso del citrato de clomifeno; particularmente en parejas jóvenes con infertilidad de corta duración y que no puedan recibir terapias más agresivas.
En general, el citrato de clomifeno es una droga bastante segura; sin embargo, no debe ser utilizada en caso de embarazo, alteración de la función hepática y quistes de ovario. Durante el embarazo, pertenece a la categoría X, que implica riesgo fetal probado, por lo que se debe usar sólo cuando el riesgo es mayor que el beneficio. Durante la lactancia es categoría U, lo que implica que sus efectos son desconocidos. Se han señalado casos en humanos de nacimiento de fetos con alteraciones del humor vítreo y de la retina de madres que ingirieron altas dosis de citrato de clomifeno en el embarazo.
Resultados. El tratamiento con citrato de clomifeno induce la ovulación en, aproximadamente, 80% de las pacientes. Sin embargo, la respuesta disminuye con el incremento de la edad, el índice de masa corporal y el índice de androgenos libres. Cuando no existen otras causas de infertilidad, la tasa acumulativa de embarazo, después de 6 ciclos de tratamiento, está entre 70% y 75%.
El citrato de clomifeno tiene una serie de efectos a nivel periférico (endocérvix, endometrio, ovario, óvulo y embrión) que explica la discrepancia entre las tasas de ovulación y de embarazo que se observan en pacientes con este tratamiento. El tratamiento con citrato de clomifeno, en parejas con infertilidad de causa desconocida, produce tasas de embarazo por ciclo que varían entre 4% y 8%. Cuando, además, se realizan inseminaciones intrauterinas, la tasa de embarazo, aumenta a entre 8% y 10%; por lo que en infertilidad de causa desconocida, se puede iniciar con inseminaciones.
 | |
Clomid® (citrato de clomifeno) | |
Efectos secundarios y riesgos. El citrato de clomifeno generalmente se tolera bien, pero se pueden presentar algunos efectos secundarios que, en la mayoría de los casos, no requiere suspender el tratamiento. El más frecuente de todos es la aparición de calorones que ocurre aproximadamente en el 10% de las mujeres y desaparece al suspender el medicamento.
Pueden aparecer trastornos visuales en menos del 2% de los casos y los más frecuentes son visión borrosa o doble, escotomas y sensibilidad a la luz. En estos casos, se debe suspender el medicamento y realizar una consulta oftalmológica porque, en algunas pacientes, se podría complicar con una neuropatía óptica. Entre otros efectos secundarios se encuentran: pérdida del cabello, nerviosismo, cefalea, congestión mamaria, depresión, somnolencia e, incluso, reacciones psicóticas.
La principal complicación del uso del citrato de clomifeno es el embarazo múltiple, que se presenta en aproximadamente 8% de los casos y que en su mayoría son gemelares. Las pacientes que reciben citrato de clomifeno pueden presentar el síndrome de hiperestimulación ovárica leve, pero el severo es poco frecuente.
GONADOTROPINAS
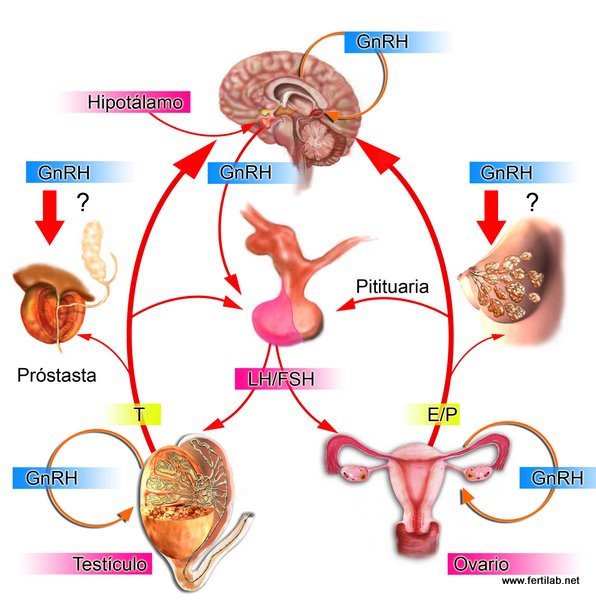 |
Regulacion hipotalamo-hipofisis testiculo-ovarios |
También conocidas como gonadotrofinas, son una serie de hormonas secretadas por la hipófisis, gracias a la hormona liberadora de gonadotropinas (GnRH), y están implicadas en la regulación de la menstruación. Existen tres gonadotropinas que son la hormona luteinizante (LH), la hormona estimulante del folículo (FSH) y la gonadotropina coriónica humana (HCG). A continuación se detallan los diversos aspectos de estas hormonas:
- Hormona luteinizante (LH). También conocida como luteoestimulante olutropina, es una hormona gonadotrópica de naturaleza glicoproteica que, al igual que la hormona estimulante del folículo (FSH) también es producida por el lóbulo anterior de la hipófisis o glándula pituitaria. En el hombre es la proteína que regula la secreción de testosterona, actuando sobre las células de Leydig, en los testículos y en la mujer estimula la ovulación femenina, controla la iniciación del cuerpo lúteo y la secreción de progesterona.
- Hormona folículo estimulante (FSH). Es sintetizada y secretada por gonadotropos de la glándula pituitaria anterior. Este estimula la secreción de estrógenos produciendo el crecimiento y la maduración de los folículos, luego en menor medida aparece la inhibina que actúan inhibiendo la actividad de la FSH, para controlar el desarrollo folicular. La FSH y LH actúan de forma sinérgica en el proceso de reproducción reproducción del cual es vital para el desarrollo del ciclo menstrual.
- Gonadotropina coriónica humana (HCG). Es una hormona que se sintetiza en el cerebro y se produce por células trofoblásticas en las mujeres embarazadas que estimula la maduración del óvulo y en los hombres la producción de testosterona en los testículos. Las células trofoblásticas son las que darán origen a la placenta, siendo éstas las que se formarán inmediatamente después de la fecundación o también puede ocurrir la formación de ciertos procesos tumorales en el hombre y en la mujer que son cancerígenos.
Dosis. Las gonadotropinas disponibles en el arsenal terapéutico para la inducción de ovulación son muy variadas y cada una tiene su propio uso como son: FSH recombinante, LH recombinante, HCG recombinante, menotropinas, urofolitropina y muchas otras que requerirían de un análisis detallado de sus dosis y funciones. Los esquemas de inducción de ovulación son bastante complejos, se puede iniciar con dosis bajas y aumentarla de acuerdo a la respuesta folicular o mantener dosis bajas durante largo tiempo.
Cuando se utilizan en técnicas de reproducción asistida de baja complejidad como inseminación artificial o coito dirigido, la meta es la de lograr menos de 3 folículos dominantes que se puedan romper, para evitar embarazos múltiples de alto número. En los casos que se vayan a someter a técnicas de reproducción asistida de alta complejidad, la meta es la de lograr tantos folículos como sea posible. El manejo de este tipo de procedimiento es aún más complejo y requiere de un especialista en reproducción asistida para obtener un mejor resultado de su acción.
Uso inadecuado. Las gonadotropinas se deben usar con precaución en pacientes con síndrome de ovarios poliquísticos por el riesgo de síndrome de hiperestimulación ovárica con embarazos múltiples. Siempre que se conozcan los factores de riesgo, se puede prevenir o evitar que llegue a ser severo, lo cual puede causar mayor morbilidad o hasta mortalidad.
Resultados. En términos generales se considera que la tasa de embarazo por ciclo en mujeres de menos de 35 años está alrededor del 15%. y de 5% en mujeres mayores de 40 años . Es importante recordar que la eficiencia de conseguir un embarazo de forma natural es entre el 20% y el 30 % por ciclo ovulatorio en mujeres de 25 años.
La tasa de embarazo acumulada al cabo de 4 ciclos de inseminación artificial es del 45%. Después de cuatro ciclos de inseminación artificial sin conseguir el embarazo, la posibilidad de lograrlo con ciclos adicionales es muy remota, por lo que se recomienda intentar otras técnicas de reproducción asistida, como la fecundación in vitro. La tasa acumulada de embarazos en fundación in-vitro y el ICSI está en alrededor del 30 al 40% en cada intento por eso constituye la técnica ideal en pacientes donde hay fracaso con la inseminación artificial.
ANÁLOGOS DEL GnRH
Se utilizan en tratamientos de reproducción asistida tales como la fecundación in vitro convencional y la ICSI porque evitan la luteinización precoz folicular y controla el momento de la ovulación para este no se produzca de forma prematura. Los que se usan en reproducción asistida son Decapeptyl®, Synarel® y Procrin®. Existen diversos protocolos de tratamiento que el especialistas en reproducción asistida deberá individualizar cada caso en particular. Las dosis de estos fármacos también se deben individualizar en función de los ciclos previos, la respuesta ovárica anterior, de la edad de la mujer, etc.
AGONISTAS DE LA GnRH
Los agonistas de la hormona liberadora de gonadotropinas GnRH (gonadotrophin releasing hormone) tanbíen son utilizados para suprimir la FSH y la LH de la hipófisis en mujeres sometidas ha ciclos de fertilización in vitro porque los altos niveles de hormona luteinizante pueden producir ovulaciones indeseadas que pueden cancelar los tratamientos de reproducción asistida.
Presentan varios beneficios, como reducción de las tasas de cancelación, mejoría del reclutamiento folicular, recuperación de mayor número de ovocitos y altas tasas de embarazo. El cetrorelix (Cetrotride®) y ganirelix (Antagon®), viene en jeringas prellenadas de 0.25 mg y se coloca durante la fase folicular del tratamiento usualmente el día 6 de la administración de FSH, Estas hormonas tambíen pueden ser empleadas en el tratamiento de la endometriosis y miomas.